Le leggi ponderali furono formulate partendo da metodi empirici per determinare la massa di atomi e molecole.
Prima di continuare a leggere gli appunti e lo schema riportati in questa pagina, devo specificare che non sono un esperto in materia ed ho usato termini ed espressioni che probabilmente presentano delle inesattezze dal punto di vista formale. Il testo serve solo per orientare il lettore ma per quanto riguarda le definizioni e la terminologia specifica, è opportuno riferirsi a quelle riportate sui libri di testo o su siti web specialistici.
Lavoisier elaborò la legge di conservazione della massa, secondo la quale in una trasformazione chimica nulla si crea e nulla si distrugge. La massa complessiva delle sostanze implicate resta sempre la stessa.
Proust elaborò la legge delle proporzioni definite, secondo la quale le proporzioni delle varie sostanze in un composto resta costante, indipendentemente dalle quantità coinvolte.
Dalton elaborò la legge delle proporzioni multiple, secondo la quale se una sostanza può combinarsi in proporzioni differenti con un’altra sostanza per creare composti distinti, le diverse quantità della prima sostanza implicate nelle diverse reazioni sono in rapporto reciproco esprimibile mediante numeri interi piccoli.



Dall’esperimento con l’acqua Dalton verificò che il rapporto tra ossigeno e idrogeno è 8 a 1. Non aveva criteri per determinare la massa relativa di ogni singolo atomo dei due elementi. Le tre ipotesi erano le seguenti:
- se nella reazione fossero stati interessati 1 atomo di ossigeno e 1 atomo di idrogeno, allora ogni singolo atomo di ossigeno avrebbe dovuto avere una massa 8 volte superiore a quella di ogni singolo atomo di idrogeno;
- se nella reazione fossero stati interessati 2 atomi di ossigeno e 1 atomo di idrogeno, allora ogni singolo atomo di ossigeno avrebbe dovuto avere una massa 4 volte superiore a quella di ogni singolo atomo di idrogeno;
- se nella reazione fossero stati interessati 1 atomo di ossigeno e 2 atomi di idrogeno, allora ogni singolo atomo di ossigeno avrebbe dovuto avere una massa 16 volte superiore a quella di ogni singolo atomo di idrogeno.
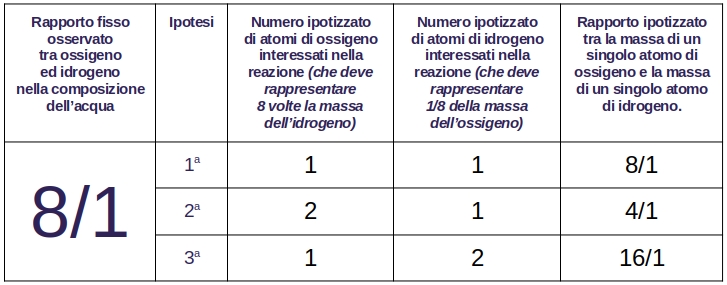
Dalton non sapeva che l’idrogeno e l’ossigeno, presi separatamente, si presentavano sotto forma di molecole biatomiche ed assunse che nella composizione dell’acqua erano coinvolti 1 atomo di ossigeno ed 1 atomo di idrogeno le cui masse fossero in rapporto 8 a 1.
Grazie alle osservazioni sperimentali di Gay-Lussac, che scoprì un’interessante regolarità nei rapporti tra i volumi dei gas di elementi che entravano in un composto ed il volume dei gas delle sostanze prodotte dalla reazione, Avogadro comprese che alcuni elementi si presentano in natura sotto forma di molecole biatomiche e formulò il principio di Avogadro secondo il quale, a parità di condizioni di temperatura e pressione, volumi identici di gas diversi contengono le stesso numero di molecole.


Esemplificando, prima che venisse formulato il principio di Avogadro non si sapeva se le differenze di massa tra due volumi identici di gas diversi dipendesse dalla differenza nella quantità di molecole contenute oppure dalla presenza di molecole con massa maggiore. Una volta stabilito che il numero di molecole di gas contenute in un’unità di volume a parità di temperatura e pressione è sempre lo stesso, una variazione della massa non può che dipendere dalle differenze di massa tra le molecole delle diverse sostanze.
Gaetano Ferrara

